Dalam memahami konsep atom perlu diketahui secara fundament mengenai karakteristik dari atom-atom penyusun. Atom-atom pada umumnya terdiri dari sebuah benda yang kita sebut dengan partikel-partikel penyusun atom. Partikel-partikel penyusun atom tersebut yang memiliki pengaruh yang sangat besar sehingga membuat sebuah atom memiliki sifat-sifat tertentu. Sebut saja Atom hydrogen yang terdiri dari partikel yang masing-masing berjumlah satu, yaitu proton dan electron berjumlah 1. Dalam pembelajaran Fisika maupun Kimia Atom, semua bentuk penjelasan mengenai atom itu merupakan sebuah permodelan yang diberikan oleh para ahli yang memiliki landasan ilmiah di setiap model atom yang diperkenalkan. Ada beberapa ahli yang menyampaikan teori model atom yang selama ini kenal. Mari kita diskusikan siapa-siapa saja yang memperkenalkan model atom tersebut.
Teori Model Atom Democritus. Permodelan model atom yang diberikan oleh Democritus menunjukkan bahwa apa yang disebut dengan atom merupakan sebuah benda yang tidak dapat dibagi. Mengapa demikian? Democritus mendapatkan penjelasan tersebut ketika mengembangkan teori tentang benda-benda penyusun materi. Artinya ketika suatu materi terus menerus di belah pada suatu saat akan diperoleh sebuah partikel penyusun fundamental/ mendasar yang disebutnya dengan Atom. Pendapat teori tentang atom ini dapat diterima pada saat itu dikarenakan kemajuan ilmu pengetahuan dan teknologi tidak berkembang seperti sekarang ini. Oleh Karena itu, kata atom berasal dari pemikiran Democritus yaitu tidak terbagi = atomos.
 |
| image from google.com.imgphp |
Teori Model Atom Aristoteles. Namun, pemikir terkenal di ranah yunani yaitu Aristoteles menyikapi pernyataan yang diberikan oleh Democritus dengan menolak pernyataan tersebut. Aristoteles berpendapat bahwa Suatu Materi/ zat tersusun atas 4 penyusun yaitu Api (Oksigen), Air (Hidrogen dan Oksigen), Tanah (unsur peyusun tanah), dan udara (Gas-gas seperti Oksigen, Nitrogen, Hidrogen dsb). Karena kondisi masyarakat yunani yang pada saat itu memiliki pemikiran suatu kepercayaan yang bersifat harus tampak, maka pendapat ini lebih diterima sehingga pendapat Democritus dianggap bohongan belaka.
 |
| Image from google.com/images |
Teori Atom Dalton. 1000 tahun lamanya, ketika di abad pertengahan di mana ilmu pengetahuan berkembang pesat terutama di dunia Islam. Cendekiawan Islam memperkenalkan konsep bahwa “sesuatu yang tak tampak itu, belum tentu tidak ada” maka istilah atom diperkenalkan lagi oleh seorang Guru SMA yang bernama John Dalton. Dalam bukunya yang berjudul New System of Chemical Philosopy, Dalton berhasil mengemukakan Model Atom Dalton. Dalam bukunya ia menuliskan bahwa tiap-tiap unsur terdiri dari atom-atom dengan sifat dan massa yang secara identik mirip dan terbentuk dengan komposisi yang tetap. Artinya perbandingan antara masing-masing atom yang sama tetap tidak dapat diganggu. Dalam situsnya Wikipedia menuliskan 5 konsep Teori Atom Dalton yakni:
- Unsur-unsur terdiri dari partikel-partikel yang luar biasa kecil yang tidak dapat dibagi kembali(disebut atom).
- Dalam reaksi kimia,mereka tidak dapat diciptakan,dihancurkan atau diubah menjadi jenis unsur yang lain.
- Semua atom dalam unsur yang sejenis adalah sama dan oleh karena itu memiliki sifat-sifat yang serupa;seperti massa dan ukuran.
- Atom dari unsur-unsur yang berbeda jenis memiliki sifat-sifat yang berbeda pula.Senyawa dapat dibentuk ketika lebih dari 1 jenis unsur yang digabungkan.
- Atom-atom dari 2 unsur atau lebih dapat direaksikan dalam perbandingan-perbandingan yang berbeda untuk menghasilkan lebih dari 1 jenis senyawa
 |
| Image from google.com/images |
Dari kelima konsep teori atom Dalton, ada 2 masalah yang harus diperbincangkan. Dari teori atom Dalton diatas pada nomor 2 dan 5 terdapat kekeliruan sehingga perlu ditinjau kembali. Apa itu? Mari kita bicarakan sejenak. Seperti yang kita ketahui bahwa dalam sistem periodic unsur tiap-tiap unsur memiliki nilai massa dan ukuran yang berbeda namun kenapa Dalton mengatakan hal yang kontradiksi? Kemudian yang kedua Apakah semua atom-atom yang didapat dari 2 unsur atau lebih dapat direaksikan sehingga terbentuk 1 senyawa ?
2 ilmuwan yang tidak sependapat dengan Dalton yaitu Sir Humphry Davy dan Michael Faraday memberikan sebuah pernyataan yang didasari atas percobaan.
Sir Humphry Davy menyatakan bahwa gas menjadi penghantar listrik yang lebih baik pada saat tekanan rendah? Bagaimana mungkin sebuah gas yang disebut Dalton bersifat netral menjadi penghantar listrik yang baik?
Di lain Pihak Secara eksperimental, Faraday menyimpulkan bahwa terdapat satuan dasar dalam atom yang belum diketahui. Hal tersebut didasari atas eksperimen yang dilakukannya yang dikenal dengan Elektrolisis Faraday. Faraday menemukan bahwa untuk menghasilkan 1 mol zat dalam elektroda diperlukan arus listrik sebesar 96.500 Coulomb. Bagaimana mungkin atom dapat mengalirkan arus listrik bila atom tersebut memiliki penyusun yang sama? Siapa yang bertanggung jawab akan lewatnya listrik pada atom tersebut?
Teori atom Dalton, tidak dapat menerangkan secara ilmiah permasalahan tersebut karena Dalton menganggap bahwa atom merupakan partikel yang tersusun sejenis/ sama sehingga bersifat netral. Namun, 1 hal yang perlu diingat bahwa, John Dalton dianggap sebagai Bapak Pencetus Teori Atom Modern dikarenakan teori beliau mampu menerangkan hukum kekekalan Massa Lavoisier dan Hukum Perbandingan Tetap Proust.
Teori Atom Thomson. Akibat permasalahan yang ditimbulkan oleh Faraday dan Davy, Thomson mencoba mencari tahu apa yang menyebabkan listrik dapat mengalir dalam suatu atom. Berdasarkan pendapat yang dikemukakan oleh Davy, Thomson melakukan percobaan dengan menggunakan tabung ruang hampa kemudian di masing-masing ujung diberikan tabung yang lebih kecil yang didalamnya berisi gas dan katode. Tabung tersebut dianamakan dengan Tabung sinar Katode.
 |
| Image from google.com/images |
Dari percobaan yang dilakukan, arus listrik dengan teganganya cukup tinggi mengakibatkan gas dalam tabung kecil yang berisi gas berpijar tergantung dari jenis zat dalam tabung. Berdasarkan teori davy, ia kemudian mem-variasikan tekanan dan suhu dalam tabung sehingga terjadi perubahan dalam tabung katode. Thomson mendapatkan: Ketika tekanan rendah dan suhu tinggi, gas dalam tabung berpijar sedangkan ketika tekanan gas dikuraingi, maka daerah depan katode menjadi gelap seiring dengan berkurangnya tekanan gas. Dan pada akhirnya, seluruh tabung menjadi gelap sedangkan bagian tabung depan katode berpendar menjadi warna kehijauan. Hal tersebut membuktikan bahwa sinar hijau tersebut merupakan sebuah radiasi yang diakibatkan oleh partikel. Karena sinar tersebut berasal dari katode, Maka, diambillah hipotesis berupa
- Sinar katode merambat lurus dari permukaan anode menuju katode
- Sinar katode dapat memutar kincir
- Sinar katode dibelokkan kea rah kutub positif
Maka, Thomson menyimpulkan bahwa Atom merupakan sebuah bola pejal yang didalamnya terdapat muatan positif dan negatif yang secara menyeluruh tersebar layaknya roti yang ditaburi kismis. Teori ini disebut dengan Teori Atom Thomson. Teori Atom Thomson ini menunjukkan bahwa terdapat bagian kecil lagi didalam atom sehingga atom bukan bagian terkecil dari suatu unsur. Disamping itu, karena terdapatnya muatan positif dan negatif dalam atom maka bagaimana mungkin terjadi reaksi kimia antar atom?
Teori Atom Rutherford. Bersamaan dengan Thomson, Rutherford melakukan percobaan untuk menjawab permasalahan yang ada mengenai teori model atom yang sebelumnya dikemukakan. Rutheford melakukan percobaan yang dikenal dengan percobaan Hamburan sinar alfa. Percobaan ini melanjutkan teori model atom Thomson yang mengatakan bahwa atom itu terdiri dari muatan positif dan negatif. Dengan mengambil partikel alfa sebagai muatan positif, Rutherford menembakkan partikel tersebut dengan arah lurus ke sebuah lembaran kertas tipis dengan tujuan apakah Atom menurut Thomson hanya terdiri dari muatan positif dan negatif saja.
 |
| Image from wikipedia.org |
Dari hasil pengamatan percobaan, didapatk bahwa partikel alfa yang ditembakkan ada partikel alfa yang tidak tertembus di bagian tengah. Seperti pengamatan yang diberikan oleh muridnya (pada saat percobaan dibantu oleh 2 murid) yaitu Marsden. Marsden mengatakan bahwa diperoleh 1 diantara partikel alfa yang ditembakkan mengalami pembelokan sudut 90 derajat atau lebih dan bahkan ada yang dipantulkan. Hal ini membuktikan bahwa ada sesuatu di bagian dalam atom tersebut yang membelokkannya. Sehingga teori atom Thomson yang menyebutkan atom terdiri dari muatan positif dan negatif yang tersebar salah, melainkan tersusun secara rapi dan periodik di dalam atom.
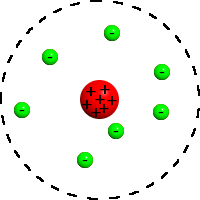
Maka, disimpulkan oleh Rutherford bahwa, sebagian besar massa atom dan muatan positif atom terkumpul di bagian pusat atom yang disebut dengan inti atom sedangkan elektron atau muatan negatif beredar mengitari pada jarak tertentu seperti susunan planet dalam tata surya dengan matahari sebagai pusatnya. Melalui gagasan ini, Rutherford menyebutkan adanya Inti Atom dalam setiap atom dan jarak antara muatan negatif yang mengelilingi inti atom disebut dengan jari-jari atom.
Maka, para ahli membuat sebuah kelebihan dan kelemahan dari teori model atom Rutherford sebagai berikut yang saya ambil dari blog teman kita yaitu :
- Kelebihan.Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
- Kelemahan. Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama - kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti Ambilah seutas tali dan salah satu ujungnya Anda ikatkan sepotong kayu sedangkan ujung yang lain Anda pegang. Putarkan tali tersebut di atas kepala Anda. Apa yang terjadi? Benar. Lama kelamaan putarannya akan pelan dan akan mengenai kepala Anda karena putarannya lemah dan Anda pegal memegang tali tersebut. Karena Rutherford adalah telah dikenalkan lintasan/kedudukan elektron yang nanti disebut dengan kulit.
Teori Atom Bohr. Dengan adanya penambahan dalam teori atom Rutherford mengenai lintasan elektron dan inti atom, maka timbul permasalahan apa yang menyebabkan elektron dalam lintasan tidak masuk ke dalam inti atom. Niels Bohr yang merupakan seorang ilmuwan berusaha memperbaiki teori atom Rutherford dengan melakukan percobaan spektrum atom hidrogen pada tahun 1911. Model Bohr merupakan sebuah Model Atom Hidrogen yang memberikan penjelasan mengenai lintasan-lintasan elektron dengan menggunakan pendekatan konsep mekanika kuantum yang lebih umum dan akurat. Namun, karena konsepnya yang sederhana namun mampu menjelaskan konsep lintasan elektron untuk orde pertama menjadikan model atom Bohr sebagai dasar pengenalan Model Atom Mekanika Kuantum.
 |
| Image from wikipedia.org |
Dalam situsnya Wikipedia menjelaskan Kunci sukses model ini adalah dalam menjelaskan formula Rydberg mengenai garis-garis emisi spektral atom hidrogen; walaupun formula Rydberg sudah dikenal secara eksperimental, tetapi tidak pernah mendapatkan landasan teoretis sebelum model Bohr diperkenalkan. Tidak hanya karena model Bohr menjelaskan alasan untuk struktur formula Rydberg, ia juga memberikan justifikasi hasil empirisnya dalam hal suku-suku konstanta fisika fundamental.
Model ini menggambarkan atom sebagai sebuah inti kecil bermuatan positif yang dikelilingi oleh elektron yang bergerak dalam orbit sirkular mengelilingi inti — mirip sistem tata surya, tetapi peran gaya gravitasi digantikan oleh gaya elektrostatik.
Untuk mengatasi hal ini dan kesulitan-kesulitan lainnya dalam menjelaskan gerak elektron di dalam atom, Niels Bohr mengusulkan, pada 1913, apa yang sekarang disebut model atom Bohr. Dua gagasan kunci adalah:
- Elektron-elektron bergerak di dalam orbit-orbit dan memiliki momenta yang terkuantisasi, dan dengan demikian energi yang terkuantisasi. Ini berarti tidak setiap orbit, melainkan hanya beberapa orbit spesifik yang dimungkinkan ada yang berada pada jarak yang spesifik dari inti.
- Elektron-elektron tidak akan kehilangan energi secara perlahan-lahan sebagaimana mereka bergerak di dalam orbit, melainkan akan tetap stabil di dalam sebuah orbit yang tidak meluruh.
Arti penting model ini terletak pada pernyataan bahwa hukum mekanika klasik tidak berlaku pada gerak elektron di sekitar inti. Bohr mengusulkan bahwa satu bentuk mekanika baru, atau mekanika kuantum, menggambarkan gerak elektron di sekitar inti. Namun demikian, model elektron yang bergerak dalam orbit yang terkuantisasi mengelilingi inti ini kemudian digantikan oleh model gerak elektron yang lebih akurat sekitar sepuluh tahun kemudian oleh fisikawan Austria Erwin Schrödinger dan fisikawan Jerman Werner Heisenberg.
Point-point penting lainnya adalah:
- Ketika sebuah elektron meloncat dari satu orbit ke orbit lainnya, perbedaan energi dibawa (atau dipasok) oleh sebuah kuantum tunggal cahaya (disebut sebagai foton) yang memiliki energi sama dengan perbedaan energi antara kedua orbit.
- Orbit-orbit yang diperkenankan bergantung pada harga-harga terkuantisasi (diskret) dari momentum sudut orbital.
- Kelebihan atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
- Kelemahan model atom ini adalah tidak dapat menjelaskan efek Zeeman dan efek Strack
Referensi
http://id.wikipedia.org/wiki/Model_Bohr
http://id.wikipedia.org/wiki/John_Dalton
http://belajarsejarahfun.blogspot.com/2011/01/sejarah-dan-perkembangan-teori-atom.html
http://jachemistry.blogspot.com/2010/01/teori-atom-ernest-rutherford.html
http://id.wikipedia.org/wiki/Model_Bohr
http://id.wikipedia.org/wiki/John_Dalton
http://belajarsejarahfun.blogspot.com/2011/01/sejarah-dan-perkembangan-teori-atom.html
http://jachemistry.blogspot.com/2010/01/teori-atom-ernest-rutherford.html












di blog ini saya menemukan informasi yang sangat logis dan objektif. thanks!!
ReplyDeleteTerima kasih. sangat membantu sekali dalam belajar
ReplyDeleteKurang !!!
ReplyDeleteSoalnya Gak sample Mekanika Kwantum Erwin Schrodinger
'_'
Tuliasannya Ke Alusan -____--
ReplyDeleteFont nya perbaiki
ReplyDeleteFont nya perbaiki
ReplyDelete